 Emissie- en absorptiespectra
Emissie- en absorptiespectra
Learning objectives
- Absorbtiespectra en emissiespectra kunnen onderscheiden.
- Een atoom karakteriseren aan de hand van zijn lichtspectrum en spectroscopie introduceren.
- Begrijpen dat de spectraalemissielijnen van een element dezelfde frequenties hebben als de lijnen van het absorptiespectrum.
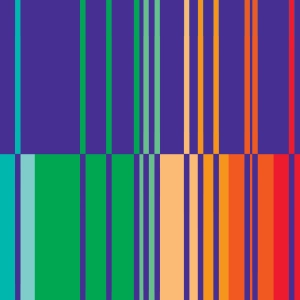
Een prisma (of een rij prisma’s) worden gebruikt om een lichtbundel te splitsen in zijn verschillende frequenties.
Het verkregen spectrum kan continu of discreet zijn (‘lijnspectrum’).
Een van de belangrijkste ontdekkingen van de quantummechanica is dat de energie van een atoom uitsluitend bepaalde vaste waarden kan hebben. Ze is ‘gekwantiseerd’ (zie de animatie over het lijnspectrum van het waterstofatoom). Hierdoor kan een gas bestaande uit één atoom een beperkt aantal frequenties uitzenden of absorberen.
Bij een gegeven element heeft het emissiespectrum (bovenste gedeelte van de animatie) dezelfde frequentie als het absorptiespectrum (onderste gedeelte).
Bron voor de waarden van de spectraallijnen: CDS Strasbourg University (link) uit Reader J., en Corliss Ch.H. CRC Handbook of Chemistry and Physics; NSRDS-NBS 68 (1980).

Discover EduMedia for free
The interactive encyclopedia that brings science and math to life in the classroom.
Over 1,000 resources